…È inoltre dimostrato che l’ipometilazione si verifica nello sperma degli uomini alcolisti. La trasmissione degli effetti dell’alcol attraverso la linea germinale maschile ha precedenti in letteratura per l’induzione di sintomi come quelli riscontrati nella FASD. Questi includono disturbi mentali, difetti cardiaci, basso peso alla nascita e iperattività, rispetto ai controlli, come valutato in studi epidemiologici sull’uomo e supportato da studi sugli animali. Ciò supporta le scoperte di Govorko e colleghi, secondo cui i fattori che influenzano la POMC e di conseguenza l’asse HPA e la FASD possono essere trasmessi dai maschi attraverso la linea germinale…

AUTORE
Claudio Diaz
CATEGORIA
Studi
POSTATO IL
23 Settembre 2022
SOCIAL
I disturbi dello spettro feto alcolico e loro trasmissione attraverso meccanismi genetici ed epigenetici
I disturbi dello spettro feto alcolico (FASD) sono un gruppo di condizioni correlate che derivano dall’esposizione prenatale al consumo materno del teratogeno etanolo. È stato stimato che circa l’1% dei bambini negli Stati Uniti soffre di FASD (Sampson et al., 1997), anche se in alcune popolazioni del mondo, come gli abitanti di alcune regioni più povere del Sudafrica, il tasso può raggiungere il 20% (May et al., 2013). I FASD sono la principale causa di ritardo mentale nei neonati statunitensi e, ironia della sorte, sono del tutto prevenibili. I FASD sono stati collegati a importanti alterazioni dell’asse ipotalamo-ipofisi-surrene (HPA), con conseguenti danni per tutta la vita attraverso disturbi mentali, ritardo e sensibilità allo stress. I FASD sono collegati a un’alterazione del sistema immunitario, che di conseguenza porta a un rischio elevato di cancro e altre malattie. I FASD derivano da una complessa interazione di fattori genetici ed epigenetici. In questa sede, rivediamo l’attuale letteratura sull’argomento per distinguere ciò che è noto in queste aree, sottolineando in particolare la disfunzione dell’asse HPA e il modo in cui questa si collega ai nuovi studi sull’ereditarietà transgenerazionale nei FASD.
Introduzione
L’impatto negativo del consumo di alcol è stato osservato fin dall’antichità e ha portato a divieti culturali sul consumo di alcol, in particolare tra le donne in età fertile. Gli antichi greci dimostrarono una certa consapevolezza dei rischi del consumo di alcol – ad esempio, Platone propose di limitare il consumo di vino nelle persone di età inferiore ai 40 anni (Abel, 1984). In alcune società antiche, come l’Impero Cartaginese, i divieti erano addirittura scritti nella legge (Jones et al., 1973; Abel, 1984). Riferimenti biblici e talmudici suggeriscono che forse gli antichi Ebrei erano consapevoli che il consumo di alcol da parte di padri e madri prima del concepimento poteva essere dannoso per la prole (Abel, 1984). Gli antichi scritti vedici elencano i divieti di bere per i bramini (Sharma et al., 2010) che suggeriscono il riconoscimento di alcuni effetti negativi dell’alcol, anche se non è chiaro se fosse noto l’impatto sulla prole. Molte fonti che parlano del consumo di alcol da parte dei genitori prima dell’era moderna si concentravano sul consumo paterno più che su quello materno (Abel, 1984). Con gli scritti di Francis Bacon del 1627, emergono le preoccupazioni per l’impatto del consumo materno di alcolici sulla prole e, all’inizio del XVIII secolo, in Inghilterra, l'”epidemia di gin” ha dato origine a commenti sul fatto che il consumo specifico di alcol durante la gravidanza danneggiasse il bambino in via di sviluppo (Abel, 1984).
Studi condotti su cavie un secolo fa hanno rilevato che non solo il consumo paterno di alcol cronico determinava un tasso di mortalità più elevato nella prole, ma che il tasso di mortalità era elevato anche nei nipoti del padre consumatore di alcol (Stockard, 1913), fornendo la prima prova conosciuta di un potenziale effetto multigenerazionale dell’esposizione all’alcol. La sindrome alcolica fetale (FAS), le manifestazioni più gravi della FASD, ha iniziato a comparire nella letteratura medica nel 1973 (May e Gossage, 2011) e la ricerca nel campo dell’esposizione fetale all’alcol ha iniziato a decollare quando la comunità dei ricercatori ha avviato uno sforzo coordinato per comprendere la FASD. Ciò ha portato alla recente scoperta di un impatto transgenerazionale dell’esposizione fetale all’alcol sulla disfunzione dell’asse dello stress. Si è scoperto che questo impatto è mediato da meccanismi epigenetici che si svolgono specificamente nella linea germinale maschile dei ratti (Govorko et al., 2012).
Disregolazione dell’asse HPA nella prole esposta all’alcol fetale
La fase fetale della vita umana è probabilmente la più suscettibile ai danni dell’alcol, poiché in questa fase si verifica lo sviluppo fondamentale di organi e vie di comunicazione. Non sorprende che le madri che consumano alcol nonostante i rischi possano creare gravi problemi di sviluppo nella loro prole. La FASD, come dice il nome, comprende un’ampia gamma di disturbi mentali, emotivi, cranio-facciali, fisiologici e immunitari che derivano dal consumo di alcol da parte della madre. In generale, la gravità del disturbo è correlata al grado di consumo di alcol da parte della madre, anche se alcuni individui sono più resistenti agli effetti di altri. Gli individui con forme più lievi di FASD possono non mostrare deformità evidenti, ma possono essere affetti da iperattività, depressione, ansia o altri disturbi che compromettono la qualità della vita (Schneider et al., 2002). All’estremo opposto ci sono gli individui con deformità visibili, grave ritardo, sistema immunitario compromesso, funzione metabolica alterata e problemi di gestione dello stress per tutta la vita, gli individui affetti da FAS (Momino et al., 2012). A livello molecolare, molti fattori causali intrecciati tra loro contribuiscono alla FASD, portando ai diversi impatti riscontrati tra coloro che ne sono affetti. Tra questi fattori, la FASD è intimamente legata alla risposta all’iperstress e ai disturbi d’ansia che sono collegati alla disregolazione delle funzioni dell’asse ipotalamo-ipofisi-surrene (HPA).
L’asse HPA è un complesso circuito neuroendocrino mantenuto dal dialogo tra ipotalamo, ipofisi e ghiandole surrenali periferiche. Il nucleo paraventricolare (PVN) dell’ipotalamo genera l’ormone di rilascio della corticotropina (CRH) e la vasopressina, stimolando la produzione del polipeptide precursore proopiomelanocortina (POMC) nel lobo anteriore dell’ipofisi. La scomposizione della POMC rilascia l’ormone adrenocorticotropo (ACTH) che dà inizio all’invio di glucocorticoidi (GC) alla circolazione periferica dalle ghiandole surrenali. Il principale GC prodotto nella corteccia surrenale umana è il cortisolo (corticosterone nei ratti). Il corticosterone può inibire la produzione di POMC nel lobo anteriore dell’ipofisi nei ratti, creando un circuito di feedback (Eberwine e Roberts, 1984). Le GC riducono le risposte infiammatorie attraverso un’azione immunosoppressiva e stimolano la risposta simpatica “combatti o fuggi”, dando una spinta rapida e temporanea a un organismo che risponde a una minaccia ambientale. Il sistema nervoso autonomo completa la risposta allo stress, sia attraverso il “combatti o fuggi” (menzionato sopra), sia attraverso il “tendi e ripara”, un processo opposto attraverso il sistema nervoso parasimpatico. L’ACTH stimola anche la produzione di catecolamine (CAT) da parte delle ghiandole surrenali. L’epinefrina, nota anche come adrenalina, e la sua controparte, la noradrenalina, sono catecolamine rilasciate dalla midollare surrenale che attivano la risposta simpatica allo stress, provocando molti dei comuni sintomi fisiologici dello stress, come sudorazione, secchezza delle fauci e battito cardiaco accelerato. Sebbene la risposta simpatica allo stress aumenti la sopravvivenza, ha un costo significativo in termini di metabolismo, sistema immunitario, digestione e altri processi fisiologici, e non può essere mantenuta all’infinito (rivisto in Rachdaoui e Sarkar, 2013; Wynne e Sarkar, 2013).
La β-endorfina è un altro prodotto peptidico della POMC generato dalla risposta allo stress. La β-endorfina è un oppioide che può regolare il dolore, ma regola anche l’ACTH (un altro prodotto peptidico della POMC; Fratta et al., 1981) e l’ormone di rilascio della corticotropina (CRH); Plotsky, 1986). La β-endorfina ipotalamica è importante per l’omeostasi della risposta allo stress. Il CRH e le catecolamine stimolano il rilascio di β-endorfina che sopprime la risposta dell’asse HPA (Boyadjieva et al., 2009). I recettori oppioidi δ e μ legano la β-endorfina centrale, regolando il sistema nervoso autonomo attraverso il PVN. I livelli di β-endorfina ipofisaria hanno un ruolo minore sul sistema nervoso autonomo e sono regolati dall’arginina vasopressina (AVP) e dal CRH (rivisto da Sarkar et al., 2012).
I neuroni della proopiomelanocortina nel nucleo arcuato dell’ipotalamo svolgono una funzione critica nella regolazione dell’asse HPA, delle vie della ricompensa e del sistema immunitario, attraverso i neuropeptidi melanocortina, ACTH e β-endorfina derivati dal polipeptide precursore POMC (Sarkar et al., 2012). Le funzioni neuronali della POMC sono risultate compromesse nei ratti fetalmente esposti all’alcol (FAE) (Sarkar et al., 2007; Hellemans et al., 2008; Boyadjieva et al., 2009). Recenti esperimenti hanno dimostrato che la sostituzione delle cellule produttrici di β-endorfina/POMC nei ratti FAE ha portato a un miglioramento dello stress e della risposta immunitaria negli animali, dimostrando un ruolo della POMC nel FASD (Boyadjieva et al., 2009).
Varianti alleliche di geni coinvolti nello sviluppo, nell’asse HPA e nel metabolismo dell’alcol giocano un forte ruolo nella suscettibilità e nei sintomi della FASD
Sebbene gli studi che dimostrano i danni ereditari dell’esposizione fetale all’alcol risalgano ad almeno un secolo fa (Stockard, 1913), è stato solo con l’uso di approcci di biologia molecolare negli anni ’80 che la scienza ha iniziato a svelare le basi genetiche dei FASD. A livello cromosomico, il danno strutturale è stato osservato con un’alta frequenza tra gli individui esposti prenatalmente in un contesto clinico. In uno studio, l’8,75% (7/80) dei pazienti con FASD sottoposti a screening genetico è risultato avere anomalie cromosomiche, tipicamente microduplicazioni o microdelezioni (Douzgou et al., 2012). Una forte evidenza della componente genetica del FASD è rappresentata dal confronto tra gemelli monozigoti e dizigoti. I gemelli monozigoti (che hanno lo stesso genoma) mostrano una concordanza del 100% per i FASD; cioè, se un gemello ha un FASD, anche l’altro lo avrà. In confronto, i gemelli dizigoti (che hanno genomi moderatamente diversi) mostrano solo il 63% di concordanza (Streissguth e Dehaene, 1993), dimostrando che anche le modeste differenze genetiche di fratelli che condividono lo stesso ambiente portano a un tasso significativamente diverso di suscettibilità alla FASD.
È noto che molteplici loci genetici sono influenzati dall’alcol, con ogni allele variante che interagisce in un complesso percorso biologico con altri geni (Johnson et al., 2006). Nei FASD, questa complessità si moltiplica in quanto i geni della madre possono avere un impatto sull’ambiente fetale e sull’espressione dei geni del feto in via di sviluppo, modellando la sua suscettibilità all’esposizione fetale all’alcol. L’RNA e le proteine materne sono presenti nell’ovocita per consentire lo sviluppo del primo embrione fino alla transizione materno-zigotica (MZT), quando i processi cellulari embrionali prendono il sopravvento (Schier, 2007). È stato dimostrato che anche gli ormoni materni svolgono un ruolo importante nello sviluppo della prole. Questi esempi dimostrano che i geni materni (e i loro prodotti) possono avere un forte impatto sullo sviluppo del feto al di là del contributo dei soli geni, definito “effetto materno”. Al contrario, la trasmissione di un fenotipo dal padre attraverso lo sperma paterno (“effetto paterno”) è più limitata, ma è stata dimostrata (Fitch et al., 1998). In breve, un’alterata espressione parentale di geni importanti potrebbe determinare una significativa vulnerabilità o resistenza della prole alla disregolazione indotta dall’etanolo nello sviluppo embrionale, anche in assenza di quei geni nel bambino, gettando una base disfunzionale o più resistente che dura tutta la vita.
Sono stati identificati anche alcuni geni che potenzialmente possono avere un ruolo diretto nella FASD. In uno studio sulle scimmie rhesus, è stato dimostrato che i feti di scimmie portatori di una variazione della regione polimorfica del gene del trasportatore della serotonina corta (rh5-HTTLPR), un allele con un analogo funzionale nell’uomo, erano particolarmente suscettibili all’esposizione prenatale all’alcol durante la prima gestazione, con conseguenti disturbi sensoriali (Schneider et al., 2009). Studi precedenti avevano indicato che questo allele era legato a una maggiore incidenza di irritabilità e reattività allo stress nella prole di scimmia sottoposta a esposizione prenatale all’alcol (Kraemer et al., 2008).
I geni che codificano per le varianti dell’alcol deidrogenasi sono risultati particolarmente rilevanti per la FASD, risultando talvolta in una diversa incidenza o gravità della FASD. In alcuni casi, possono alterare i modelli di consumo materno: Le varianti dell’ADH sono state collegate alla dipendenza da alcol, mentre altre varianti possono indurre le madri a bere meno. Le alcool deidrogenasi sono presenti in modo ubiquitario in tutti i regni degli organismi viventi. I prodotti di questi geni sono coinvolti nella conversione degli alcoli (ROH) in aldeidi (R-CHO) e chetoni (RCOR’) attraverso la riduzione del coenzima nicotinammide adenina dinucleotide (NAD+ ) in NADH. Nell’uomo esistono sei diverse ADH e l’alcol deidrogenasi svolge un ruolo importante nel metabolismo dell’etanolo e nella dipendenza da alcol. Varianti a metabolizzazione più lenta di ADH2 e -3 sono state collegate all’alcolismo nelle popolazioni asiatiche (Osier et al., 1999). ADH1B ha un forte legame con l’alcolismo (Li et al., 2011). Per quanto riguarda la FASD, è stato scoperto che gli alleli materni di ADH1B, ADH1B*2 e ADH1B*3 (entrambi relativamente comuni nelle popolazioni di origine africana), che metabolizzano rapidamente l’alcol, determinano una riduzione dell’incidenza di FASD nella prole, anche in quelle prive del gene (Warren e Li, 2005; Jacobson et al., 2006). È noto che ADH1B*3 porta a una riduzione dell’assunzione di alcol, quindi è possibile che crei una spiacevole associazione con elevati livelli di aldeidi attraverso una rapida metabolizzazione dell’alcol, oppure che l’enzima contribuisca a proteggere la prole riducendo il picco dei livelli di alcol nel sangue, un fattore critico nel determinare la quantità di danni causati ai feti (Jacobson et al., 2006), suggerendo che questi potrebbero essere meccanismi alla base della riduzione dell’incidenza di FASD. Nei topi fetali esposti all’alcol, le varianti dei genotipi di aldh2, un gene dell’alcol deidrogenasi, sono state collegate a difetti nello sviluppo del cervello e della vista. Questo fenomeno è stato esacerbato nei topi privi di fancd2, che svolge un ruolo a valle nell’elaborazione dei metaboliti aldeidici dell’alcol (Langevin et al., 2011). Nei pesci zebra, i pesci nulli di mars (un gene coinvolto nel metabolismo dell’alcol) sono stati collegati a difetti nello sviluppo e a disfunzioni cerebrali durante uno studio embrionale sull’alcol (McCarthy e Eberhart, 2014). Altri geni influenzati dall’etanolo in uno studio embrionale sull’alcol condotto su zebrafish includono hinfp, plk1, foxd1 e vangl2, che hanno un significato nei processi cellulari come la traduzione e il ciclo cellulare e nello sviluppo precoce (McCarthy e Eberhart, 2014). I dati bioinformatici estratti dai risultati delle ricerche pubblicate in letteratura hanno identificato, da uno screening di oltre 10.000 geni candidati, un sottoinsieme di 87 geni all’interno delle vie di segnalazione TGF-β, MAPK e Hedgehog, probabilmente rilevanti per la FASD. Tra questi, gnas e msx1, importanti per l’apoptosi e la segnalazione cellulare, fgfr1-3, importanti per lo sviluppo osseo embrionale, e bmp4, importante per la miogenesi. Sono stati inclusi anche foxg1b, hoxa1 e pax6, importanti per lo sviluppo del cervello (Lombard et al., 2007). Questi geni sono stati esaminati attraverso l’analisi dei pathway, delle proteine e dei legami di trascrizione e sono ricchi di obiettivi per gli studi sulla genetica della FASD. Inoltre, si adattano bene ai cambiamenti fenotipici osservati nei pazienti con FASD, tra cui deformità facciali, irregolarità cardiovascolari, difetti scheletrici e difetti di crescita cerebrale (Clarren et al., 1978; Clarren, 1986).
In sintesi, sono stati identificati molti geni legati al metabolismo dell’alcol o allo sviluppo e all’asse dello stress HPA in relazione alla FASD. È stato dimostrato che le varianti di alcuni di questi geni contribuiscono alle diverse risposte all’esposizione fetale all’alcol e sembra probabile che anche altri geni contribuiscano. Questo può spiegare in parte perché la percentuale di donne che bevono durante la gravidanza è molto più alta della percentuale di bambini che nascono con FASD.
L’esposizione fetale all’alcol provoca cambiamenti epigenetici critici per la FASD
L’epigenetica si riferisce a cambiamenti nell’espressione genica che non derivano da cambiamenti nella sequenza del DNA sottostante. Le tossine ambientali, come l’etanolo, possono influire sull’espressione dei geni alterando i modelli di metilazione del DNA o modificando le code degli istoni mediante metilazione o acetilazione. Gli studi epigenetici relativi alla FASD sono ancora un campo emergente (Haycock, 2009), ma hanno portato alla scoperta che molti sintomi della FASD possono essere ricondotti almeno in parte a segni epigenetici aberranti depositati durante la produzione dei gameti o durante lo sviluppo embrionale sotto l’influenza dell’alcol. Studi recenti hanno rilevato cambiamenti epigenetici permanenti dovuti all’etanolo (Govorko et al., 2012) e possono agire in modo esteso su tutto il genoma (Kaminen-Ahola et al., 2010). Sia la metilazione del DNA che le modifiche degli istoni, due dei meccanismi epigenetici più comunemente studiati, possono alterare l’accessibilità del DNA al macchinario trascrizionale molecolare, fornendo un potente metodo per l’etanolo di creare scompiglio nello sviluppo attraverso la modifica dell’espressione dei geni (Renthal e Nestler, 2009).
Metilazione del DNA
Il processo di metilazione del DNA comporta il trasferimento di un gruppo metile da parte di una DNA metiltransferasi (DNMT), che utilizza la S-adenosil metionina (SAM), al carbonio C5 di un residuo di citosina, tipicamente in regioni contenenti stringhe di dinucleotidi CpG (isole CpG); Bestor, 2000). Le isole CpG (CGI) sono tradizionalmente definite in quanto presentano un tratto esteso di nucleotidi (>200 basi), una composizione di nucleotidi C/G superiore al 50% e un contenuto di dinucleotidi CpG osservato del 65+% (Gardiner-Garden e Frommer, 1987). Circa il 70% dei promotori annotati mostra la presenza di CGI che contengono siti di inizio trascrizione (TSS) o sono vicini ad essi (Saxonov et al., 2006). Nei vertebrati, le CpG sono complessivamente poco abbondanti e spesso metilate; tuttavia, le CpG nelle CGI sono spesso non metilate (Deaton e Bird, 2011). Circa la metà delle CGI nel topo e nell’uomo sono associate a TSS (Illingworth et al., 2010; Deaton e Bird, 2011). Le restanti, soprannominate “CGI orfane”, sono spesso associate a nuovi promotori (Illingworth et al., 2010; Maunakea et al., 2010).
La metilazione delle isole CpG è spesso regolata durante lo sviluppo per controllare l’espressione genica e il livello di metilazione è correlato all’entità dell’inattivazione genica (Doerfler, 1983).
L’alcol può influenzare la metilazione del DNA attraverso un impatto sugli enzimi metilanti chiave, come le DNA metiltransferasi (DNMT). Alcuni studi hanno dimostrato che un metabolita a valle della degradazione dell’alcol, l’acetaldeide, può inibire la DNMT1 (Garro et al., 1991). I cambiamenti nella metilazione del DNA possono avvenire anche alterando le vie interconnesse della colina, della metionina e del 5-metiltetraidrofolato (folato), che forniscono substrati chiave per la metilazione (Hamid et al., 2009). L’esposizione all’alcol può agire attraverso i folati (Hidiroglou et al., 1994) e la S-adenosilmetionina (SAM; Barak et al., 1993; Lu et al., 2000). L’alcol riduce l’assorbimento di folato dalla dieta, una vitamina necessaria per le reazioni di trasferimento del carbonio nella via metionina-omocisteina, limitando la metilazione del DNA (Halsted et al., 2002). La carenza di folato è legata all’ipometilazione globale del DNA (Kim et al., 1997). L’integrazione di colina riduce i sintomi della FASD fornendo sufficienti gruppi metilici alla via metinone-omocisteina (Thomas e Tran, 2012); Bekdash et al., 2013Wozniak et al., 2013).
La metilazione aberrante mediata dall’alcol è stata documentata in almeno diversi geni dello sviluppo negli esseri umani che abusano di alcol (Bönsch et al., 2006; Hillemacher et al., 2009). Inoltre, l’alcol può agire attraverso la demetilazione (Ponomarev, 2013). È stato osservato che i cambiamenti nella metilazione del DNA si verificano durante lo sviluppo precoce. Liu et al. (2009) ha riscontrato un’estesa metilazione nei geni dello sviluppo di embrioni di topo esposti all’alcol (Liu et al., 2009). Kaminen-Ahola et al. (2010) ha rilevato che il gene Avy nei topi era ipermetilato in seguito all’esposizione all’alcol nelle prime fasi dello sviluppo fetale. Gli studi sull’esposizione prenatale all’alcol nei topi hanno dimostrato alterazioni della metilazione del DNA con conseguenti difetti neurofacciali e di crescita analoghi alla FASD nell’uomo (Liu et al., 2009). L’esposizione all’alcol altera i profili di metilazione del DNA negli embrioni di topo nelle prime fasi della neurulazione e altera la metilazione dei geni imprintati, noti per il loro ruolo nel ciclo cellulare, nella crescita, nell’apoptosi, nel cancro e in un gran numero di geni associati all’olfatto. Questi risultati indicano che in risposta all’alcol durante lo sviluppo fetale si verificano cambiamenti genici specifici e globali nella metilazione del DNA.
L’esposizione all’etanolo e ad altre sostanze tossiche durante le fasi critiche dello sviluppo può essere particolarmente dannosa e può causare cambiamenti epigenetici nell’espressione genica del cervello che hanno un impatto sul cervello per tutta la vita dell’organismo (Kobor e Weinberg, 2011Ungerer et al., 2013; Nestler, 2014). L’alcol è altamente dannoso prima e durante lo sviluppo precoce, in particolare in tre momenti. Quando i gameti vengono prodotti o stanno maturando, sono vulnerabili all’abuso di alcol (Haycock, 2009), come dimostrato da diversi studi (Ouko et al., 2009; Govorko et al., 2012). Ciò è probabilmente dovuto al fatto che in questo periodo il DNA viene attivamente riconfezionato. Inoltre, le cellule germinali persistono per lunghi periodi di tempo nell’organismo, fornendo una finestra più lunga per le azioni di esposizioni ripetute a tossine ambientali come l’etanolo. Un secondo periodo altamente vulnerabile si verifica dopo la fecondazione ma prima dell’impianto, quando l’embrione subisce rapidi cambiamenti di sviluppo e si prepara all’impianto. Il terzo si verifica durante la gastrulazione, quando si stanno definendo i tre strati germinali. Di conseguenza, i marchi istonici vengono depositati per specificare i tipi di cellule (Shi e Wu, 2009) e l’embrione in via di sviluppo è più vulnerabile all’alcol in questa fase (Armant e Saunders, 1996; Haycock, 2009).
Studi condotti sui ratti hanno rilevato che l’espressione della POMC è influenzata dall’esposizione all’alcol fetale, con conseguente perdita di neuroni produttori di β-endorfina e riduzione dell’espressione della POMC (Chen et al., 2006; Sarkar et al., 2007Kuhn e Sarkar, 2008). È stato riscontrato che l’etanolo è in grado di aumentare la metilazione del DNA della regione promotrice della POMC nei cuccioli fetali, modificando le marcature epigenetiche per ridurre l’espressione della POMC (Govorko et al., 2012). Questo è importante in quanto i neuroni POMC, situati nell’ipotalamo, sono fondamentali per l’omeostasi dello stress. La perturbazione dell’asse HPA è una causa diretta di molti dei sintomi associati alla FASD, tra cui una risposta allo stress carente, depressione, ansia e immunità compromessa (Sarkar, 1996; Pritchard et al., 2002Raffin-sanson et al., 2003; Sarkar et al., 2012; Rachdaoui e Sarkar, 2013).
In breve, si è scoperto che la metilazione del DNA è un fattore importante nell’incidenza dei FASD. L’alcol agisce attraverso diverse vie per influenzare la metilazione del DNA e sembra essere particolarmente dannoso in fasi specifiche dello sviluppo embrionale, provocando cambiamenti significativi nella metilazione che possono durare tutta la vita.
Modifica degli istoni
Le modificazioni degli istoni sono altri importanti processi biologici attraverso i quali avviene la modifica epigenetica dell’espressione genica. Il DNA viene avvolto intorno agli istoni, influenzando la sua capacità di interagire con il macchinario trascrizionale. L’impacchettamento stretto comporta una minore interazione. Le modifiche covalenti alle code degli istoni 3 e 4 (H3 e H4) sono comunemente studiate. Tuttavia, H3 e H4 non sono gli unici istoni che possono essere modificati epigeneticamente. Per H3 e H4, l’eterocromatina, lo stato di silenziamento, è associata all’ipoacetilazione (stato de-acetilato) e alla di- o trimetilazione del novantesimo residuo di lisina su H3 (H3K9me2 o H3K9me3). Lo stato aperto, l’eucromatina, è associato all’acetilazione di H3 e H4 e alla di- o trimetilazione del quarto residuo di lisina di H3 (H3K4me2 o H3K4me3); Arney e Fisher, 2004). Pertanto, la metilazione degli istoni, a seconda del bersaglio della metilazione, può determinare un cambiamento nell’espressione in entrambe le direzioni. Ci può essere una regolazione coordinata tra le modificazioni degli istoni e altri meccanismi epigenetici, tra cui la metilazione del DNA (Jin et al., 2011).
I segni istonici sono stati collegati al consumo di alcol (Pal-Bhadra et al., 2007Pandey et al., 2008). L’alcol provoca la formazione di marcature istoniche in specifiche posizioni genomiche (Kim e Shukla, 2006). Di solito negli studi sull’alcol si tratta di H3K4me3 (residuo dell’istone 3 lisina 4, trimetilato) e di acetilazione/deacetilazione di H3 e H4 (Ponomarev, 2013). Govorko et al. (2012) ha scoperto che la deacetilazione degli istoni si verifica nei cuccioli di ratto fetale esposti all’etanolo, portando a una riduzione dell’espressione della POMC, che spiega in parte la successiva alterazione dell’asse HPA e i sintomi FASD osservati. Per un riepilogo delle conoscenze attuali, si veda la Figura 1.
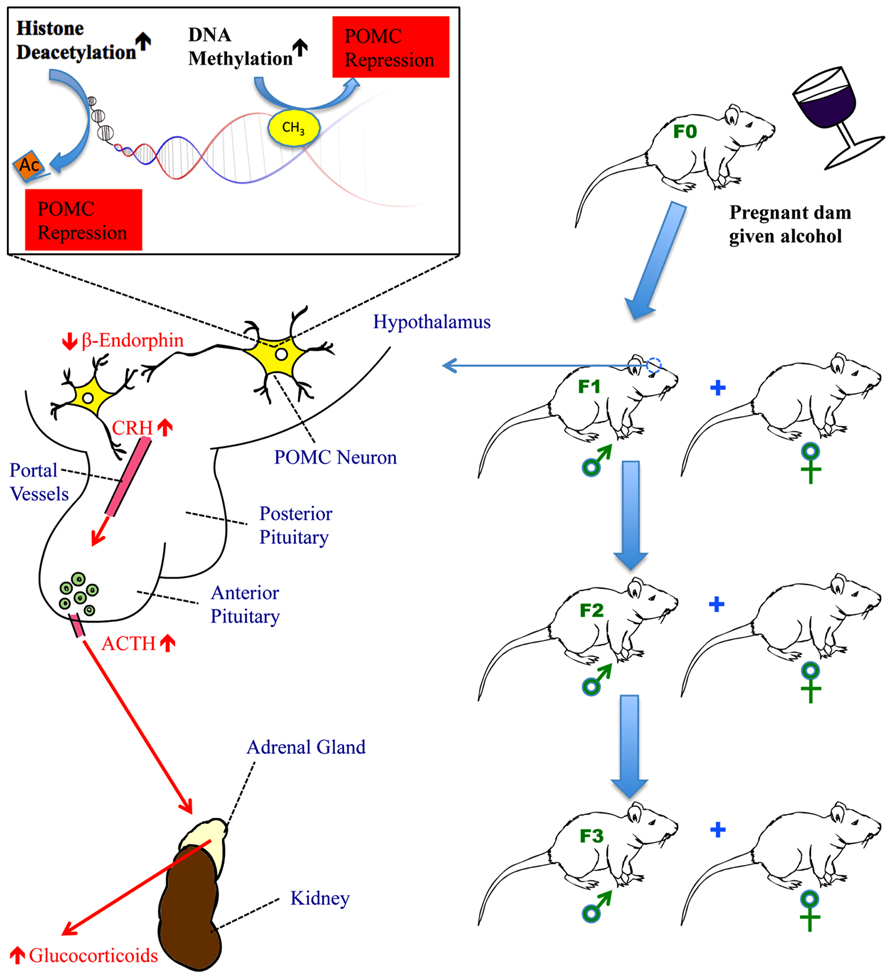
FIGURA 1. IMPATTO DELL’ESPOSIZIONE FETALE ALL’ALCOL SULL’ASSE IPOTALAMO-IPOFISI-SURRENE (HPA).
L’esposizione all’alcol fetale aumenta l’attività delle DNA metiltransferasi per metilare le CpG nel promotore del gene POMC nell’ipotalamo e attiva le istone deacetilasi per rimuovere i gruppi acetilici dagli istoni in prossimità del gene POMC. Sia la metilazione che la deacetilazione portano alla repressione della trascrizione del gene POMC. Ciò comporta una riduzione della produzione di β-endorfina, un peptide derivato dal gene POMC, nell’ipotalamo. La riduzione della produzione di β-endorfina interrompe la normale regolazione a feedback dell’asse HPA, causando un’iper-risposta del CRH in seguito allo stress e, di conseguenza, un aumento della secrezione di ACTH dall’ipofisi anteriore e di glucocorticoidi (corticosterone nei ratti e cortisolo nell’uomo) dalla ghiandola surrenale. Nei ratti fetali esposti all’alcol, l’asse HPA è disregolato, con conseguente risposta all’iperstress, disfunzioni mentali e un sistema immunitario compromesso. L’ipermetilazione del gene POMC e il suo conseguente impatto sull’asse HPA persistono per un minimo di tre generazioni di progenie, veicolate dalla linea germinale maschile.
Numerosi studi sull’impatto dell’etanolo sullo sviluppo sono stati condotti utilizzando modelli di coltura cellulare. Lo sviluppo cardiaco è stato influenzato dall’etanolo utilizzando cellule progenitrici cardiache. In caso di esposizione all’etanolo, si è riscontrato che lo sviluppo del cuore è stato significativamente influenzato e che si è verificata l’acetilazione di H3. L’effetto era dose-dipendente, con maggiori cambiamenti nell’espressione genica a dosi più elevate di etanolo (Zhong et al., 2010). Nelle neurosfere di cellule staminali neuronali fetali, è stato osservato che l’etanolo rimuove i segni di metilazione degli istoni dai promotori (H3K4me3 e H3K27me3, o entrambi) in 20 geni candidati che svolgono ruoli in processi quali la regolazione della biologia delle cellule staminali neurali e il patterning neurale (Veazey et al., 2013). L’etanolo ha anche influito sulla firma bivalente delle cellule ES-like (Veazey et al., 2013). È interessante notare che per la maggior parte dei geni il controllo trascrizionale non è stato modificato dalla variazione delle modificazioni istoniche (Veazey et al., 2013).
Di per sé, gli studi sulla metilazione H3K4me3 in relazione all’esposizione all’alcol sono risultati non essere un buon predittore di espressione (Ponomarev, 2013). Alcuni risultati recenti hanno suggerito che le modificazioni globali della cromatina in relazione all’esposizione a farmaci tendono a essere transitorie e a ritornare a stati “normali” entro ore o giorni dalla rimozione del tossico, suggerendo che i cambiamenti globali potrebbero non essere informativi (Nestler, 2014). Sebbene in alcuni studi siano transitori, se i danni da metilazione aberrante si verificano in momenti critici, come durante lo sviluppo fetale, quando si stanno formando le strutture fondamentali, almeno alcuni degli effetti potrebbero essere permanenti.
Modificazioni epigenetiche come quelle sopra descritte sono state collegate a molte malattie, tra cui i principali disturbi mentali come la depressione, la schizofrenia, il disturbo bipolare (“maniaco-depressivo”) e la dipendenza (Jaenisch e Bird, 2003; Eger et al., 2004; Hsieh e Gage, 2005; Sharma et al., 2008; Maze e Nestler, 2011). Haley et al. (2006) hanno scoperto che l’asse dello stress HPA nei neonati è stato influenzato dall’esposizione fetale all’alcol, probabilmente a causa di cambiamenti epigenetici durante la gastrulazione. Dati i legami tra l’asse HPA, la FASD e i disturbi mentali, la comprensione della disregolazione della POMC attraverso meccanismi epigenetici potrebbe portare a una migliore comprensione di queste malattie e a nuove vie di trattamento.
MicroRNA
I microRNA (miRNA) sono una classe di RNA non codificanti. Hanno una lunghezza di circa 22nt e funzionano principalmente come bersaglio della regione 3′ non tradotta (UTR) dei trascritti, portando alla loro downregulation. I MiRNA si sono rivelati sempre più importanti regolatori genici post-trascrizionali coinvolti in molti processi biologici in tutti gli animali e nella maggior parte dei regni (Recensione in Berezikov, 2011). Gli effetti dei microRNA nell’esposizione fetale all’alcol possono verificarsi sia a livello genetico sia a livello epigenetico. È stato osservato che l’espressione dei miRNA varia da un individuo all’altro, determinando cambiamenti nella predisposizione e nella gravità delle malattie (Chu et al., 2012); Lukiw, 2013). In alcuni casi, i polimorfismi a singolo nucleotide (SNP) nei geni che codificano i miRNA hanno un impatto sulla loro espressione e funzione (Sun et al., 2009). Queste differenze individuali potrebbero portare a differenze significative nelle conseguenze per la prole del consumo di alcol da parte della madre. In alternativa, l’espressione dei microRNA può essere modificata dall’etanolo attraverso meccanismi epigenetici (Miranda, 2012) e, poiché i microRNA interagiscono direttamente con il meccanismo epigenetico a più livelli (rivisto in Singh e Campbell, 2013), sembra probabile che il consumo materno di etanolo possa influenzare anche la metilazione del DNA e l’acetilazione/deacetilazione degli istoni attraverso i microRNA. Poiché i miRNA sono stati implicati in modelli di FASD in studi sui roditori, in particolare nello sviluppo neurale (Wang et al., 2009Miranda, 2012), le alterazioni dell’espressione dei miRNA hanno probabilmente un ruolo significativo nello sviluppo della FASD nei figli di donne che abusano di alcol.
Esistono anche prove dell’interazione dei miRNA con l’asse HPA dello stress. Recentemente è stato dimostrato nei topi che lo stress paterno può avere un impatto sull’asse dello stress HPA, attraverso meccanismi epigenetici che agiscono sul DNA dello sperma per trasmettere cambiamenti ereditabili (Rodgers et al., 2013). Tra i microRNA dell’elenco di quelli influenzati dallo stress paterno che interagiscono con l’asse dello stress HPA, è stato riscontrato che l’espressione di miR-29c e miR-204 cambia in seguito all’esposizione all’alcol nella corteccia prefrontale del ratto adulto (PFC); Tapocik et al., 2013), mentre i miR-29c e -30a sono risultati alterati nel cervello di topi fetali durante l’esposizione all’etanolo materno (Wang et al., 2009), suggerendo che questi microRNA possono avere un impatto sullo sviluppo dell’asse HPA durante l’esposizione fetale all’alcol.
Ereditarietà epigenetica transgenerazionale dei sintomi FASD
Le modificazioni epigenetiche ereditabili giocano un ruolo in molte malattie
L’eredità epigenetica transgenerazionale, ovvero i cambiamenti trasportati attraverso la linea germinale (Guerrero-Bosagna et al., 2010; Thornburg et al., 2010), fornisce una spiegazione a domande a cui i biologi molecolari non sono stati in grado di rispondere attraverso la sola genetica. Le modificazioni epigenetiche ereditabili svolgono un ruolo chiave in alcune malattie umane. Diverse sindromi presenti in letteratura includono la sindrome di Angelman, Prader-Willi e Beckwith-Wiedemann. Queste sono legate a modifiche ereditabili, come le delezioni, in specifiche regioni cromosomiche che subiscono un imprinting genomico (Adams, 2008). Nell’imprinting, negli spermatozoi e negli ovuli si verificano differenze parentali nelle modifiche epigenetiche di geni specifici, con conseguente espressione genica genitore-specifica. Quando il contributo di un genitore a un gene viene silenziato attraverso meccanismi epigenetici, l’eliminazione della copia dell’altro genitore comporta la perdita della funzione del gene.
Le modificazioni epigenetiche transgenerazionali sono rare
Le marcature epigenetiche transgenerazionali sui geni sono meno comuni di quelle transitorie, poiché la maggior parte delle firme epigenetiche viene tipicamente persa durante la gametogenesi. In alcuni casi, alcuni segni possono essere mantenuti a causa di una distorsione nella rimozione (Morison e Reeve, 1998). Alcuni geni continuano a mostrare la metilazione parentale delle regioni del promotore (Borgel et al., 2010). Molti segni epigenetici vengono rimossi durante la meiosi (Bond e Finnegan, 2007) e il DNA viene nuovamente metilato durante le prime fasi dello sviluppo, spesso per marcare la specificità del tipo di cellula (Shi e Wu, 2009), dato che nell’organismo esistono oltre 200 tipi di cellule diverse (Alberts et al., 2002).
Prima della fecondazione, il gamete maschile porta con sé la firma epigenetica germinale del padre. Tuttavia, quando avviene la fecondazione, la maggior parte dei segni epigenetici del maschio viene persa. Durante la produzione dello sperma, le protamine condensano il DNA paterno, proteggendolo e sostituendo la maggior parte degli istoni. Tuttavia, non tutti gli istoni vengono sostituiti; alcuni istoni che rimangono mantengono i loro marchi epigenetici precedenti (Hammoud et al., 2009; Brykczynska et al., 2010). Durante l’interazione tra lo spermatozoo e l’ovulo, dopo che le membrane nucleari si fondono e il DNA dello spermatozoo si deposita, le protamine vengono perse e sostituite con gli istoni dell’ovulo. Il DNA del maschio entra in uno stato più aperto – la maggior parte degli istoni di sostituzione sono acetilati e gran parte della metilazione presente nel DNA viene rimossa (Oswald et al., 2000); Fulka et al., 2004). È interessante notare che alcune regioni sembrano essere protette dalla demetilazione, compresi i geni imprintati (Li, 2002). Dopo la fusione, gli enzimi materni rimetilano regioni significative del DNA dello spermatozoo.
Gli effetti epigenetici transgenerazionali dovuti all’esposizione a sostanze chimiche pericolose sono stati documentati per 4 o più generazioni (Anway et al., 2005). Per essere considerato un effetto epigenetico transgenerazionale, l’effetto deve persistere per più generazioni. Il numero di generazioni necessarie per dimostrare un effetto epigenetico transgenerazionale varia a seconda che l’effetto sia trasmesso per via materna o paterna. Nel caso della trasmissione materna, per dimostrare un effetto epigenetico transgenerazionale sono necessarie tre generazioni di prole affetta. Questo perché il feto (F1) all’interno della madre (F0) sta sviluppando le gonadi (che danno origine alla generazione F2), quindi un effetto puramente ambientale potrebbe in teoria avere un impatto diretto sul nipote attraverso alterazioni delle gonadi di F1, portando a un effetto multigenerazionale, ma non dimostrando una trasmissione epigenetica ereditabile. Pertanto, per dimostrare la persistenza dell’effetto, devono essere influenzate tre generazioni (F3) di progenie. Per la trasmissione paterna, il numero minimo di generazioni impattate è due, cioè il nipote del fondatore. Gli spermatozoi potrebbero essere colpiti direttamente da un agente ambientale, con conseguente impatto sulla progenie F1, ma sarebbe necessario un meccanismo epigenetico per trasmettere questo effetto alla generazione F2 (Jirtle e Skinner, 2007).
Le modifiche epigenetiche transgenerazionali causate dal consumo materno di alcool possono procedere attraverso la germellina maschile
In letteratura esistono diverse dimostrazioni multigenerazionali dell’ereditabilità dei disturbi legati all’alcol. In un recente studio su donne native americane che hanno abusato di alcol, i figli di generazione F2 (cioè i nipoti) di una donna che ha abusato di alcol hanno una maggiore tendenza a manifestare FAS rispetto ai figli F2 di donne di controllo (Kvigne et al., 2008). Recentemente, Govorko et al. (2012) ha dimostrato che, in seguito all’esposizione in utero all’etanolo, le regioni regolatorie della POMC nell’ipotalamo dei ratti subiscono modifiche epigenetiche: alterazione dei segni istonici e metilazione del DNA del promotore prossimale. Inoltre, è stato dimostrato che le HDAC che modificano gli istoni e le DNA metiltransferasi (DNMT) subiscono un impatto, suggerendo una relazione causale tra l’alcol e i cambiamenti epigenetici. Di conseguenza, i neuroni POMC subiscono un impatto su almeno tre generazioni, perturbando l’espressione di peptidi chiave derivati dalla POMC, come la β-endorfina, e influenzando la produzione del suo messaggero a valle, il corticosterone, con conseguente disregolazione dell’asse HPA e un’elevata risposta allo stress nella prole adulta. Si tratta della prima dimostrazione di un vero effetto epigenetico transgenerazionale dell’esposizione prenatale all’alcol. È interessante notare che Govorko et al. (2012) sono stati in grado di invertire questo effetto attraverso inibitori dell’HDAC e della metilazione del DNA, fornendo un ulteriore supporto alle loro conclusioni.
È inoltre dimostrato che l’ipometilazione si verifica nello sperma degli uomini alcolisti (Ouko et al., 2009). La trasmissione degli effetti dell’alcol attraverso la linea germinale maschile ha precedenti in letteratura per l’induzione di sintomi come quelli riscontrati nei FASD. Questi includono disturbi mentali, difetti cardiaci, basso peso alla nascita e iperattività, rispetto ai controlli, come valutato in studi epidemiologici sull’uomo e supportato da studi sugli animali (Abel, 2004). Ciò supporta le scoperte di Govorko e colleghi, secondo cui i fattori che influenzano la POMC e di conseguenza l’asse HPA e la FASD possono essere trasmessi dai maschi attraverso la linea germinale.
Riepilogo e direzioni future
i FASD sono causati da una complessa interazione tra geni e ambiente ed è regolata da geni sia parentali che fetali. Alcuni sintomi dei FASD sono causati dalla diminuzione dell’espressione della POMC e del suo prodotto peptidico, la β-endorfina, importante nella regolazione dell’asse dello stress HPA. Recenti studi di Govorko et al. (2012) hanno chiarito che i cambiamenti epigenetici della POMC vengono trasmessi per diverse generazioni attraverso i cuccioli della linea germinale maschile discendenti da animali esposti all’alcol fetale. Attualmente non è noto come ciò avvenga, poiché le modifiche dirette agli enzimi coinvolti nella metilazione e nella deacetilazione dovrebbero avere un impatto anche sulla progenie femminile. Si ipotizza che la regione non appaiata del cromosoma Y, che è eucromatica, possa essere parzialmente protetta dalla demetilazione e possa trasportare le modifiche epigenetiche alla futura progenie maschile.
La reversibilità del difetto del sistema POMC dimostrata da Govorko e colleghi attraverso la modulazione dei componenti del meccanismo epigenetico può avere un potenziale terapeutico. Gli inibitori dell’istone deacetilasi si sono dimostrati efficaci nel ridurre alcuni sintomi del danno da alcol. Essi agiscono impedendo alle HDAC di rimuovere i gruppi acetilici dalle code degli istoni, mantenendo così uno stato potenzialmente attivo dal punto di vista trascrizionale. Studi sui ratti hanno dimostrato che questo può migliorare i sintomi dei FASD (Govorko et al., 2012), e può anche funzionare per prevenire la tolleranza e l’astinenza nei ratti adulti (Sakharkar et al., 2012).
La colina influenza i livelli di SAM e la carenza di colina durante lo sviluppo imita fenotipicamente la carenza di folato (Zeisel, 2004, 2006). L’integrazione di cloruro di colina ha avuto successo nel ridurre l’impatto del consumo materno di alcol sul feto in via di sviluppo (Thomas et al., 2007, 2010); Bekdash et al., 2013). L’uso di integratori a base di colina e inibitori di HDAC o DNMT per attenuare i sintomi dei FAS nei ratti suggerisce che l’integrazione potrebbe aiutare le popolazioni a rischio durante la gravidanza, anche se è necessario condurre ulteriori studi in questo ambito. Inoltre, gli sviluppi nella comprensione della regolazione epigenetica della POMC possono suggerire ulteriori strategie di trattamento per ridurre i sintomi della malattia legati all’asse dello stress HPA negli adulti e, dati i collegamenti con altri disturbi, come il cancro e i disturbi mentali, gli effetti di questa ricerca potrebbero essere di vasta portata. Il futuro è promettente.
Clicca QUI se vuoi leggere il testo originale.
Iscriviti & Riceverai info aggiornate
Tieniti aggiornato sulla FASD e su tutte le attività dell’associazione
Saremo molto accorti nell’utilizzo della tua email. Non la daremo mai a nessun’altro.